上海有機所揭示硫肽類抗生素的生物合成酶學機制
近期,中國科學院上海有機化學研究所生命有機化學國家重點實驗室研究員劉文課題組在國際上首次闡明了硫鏈絲菌素(Thiostrepton,TSR)側環形成過程中關鍵大環化反應的酶學機制,相關成果已于11月24日在線發表于國際期刊《美國科學院院報》(Proc. Natl. Acad. Sci. USA., 2016, DOI: 10.1073/pnas.1612607113)。
硫肽抗生素是一類古老的生物活性肽抗生素,該家族成員目前已被發現超過一百余種。雖然此類天然產物的結構復雜、種類多樣,但是其生物合成途徑卻存在共性,即底物均為一段高度后修飾的由核糖體翻譯而來的多肽。對于此類抗生素生物合成途徑的研究,不但有利于使用經過改造后的“微生物工廠”來生產制備新型的藥物前體,還拓展了人們對于特殊蛋白質/多肽翻譯后修飾反應的理解和認識。該家族中的硫鏈絲菌素具有獨特的雙大環骨架結構和優良的生物活性(包括抗細菌、抗支原體、抗癌、抗瘧和免疫抑制等活性),引起了科研人員強烈的興趣。
劉文課題組長期以來致力于硫鏈絲菌素的生物合成與分子改造的研究。在前期的工作中,他們基于該分子生物合成途徑的特殊性,設計并開發了一套基于“前體導向突變生物合成”的TSR分子改造策略。利用該策略,他們成功獲得了多個活性顯著超出母體化合物的TSR衍生物,并制備了首個含有氟元素和氯元素的TSR分子(Org. Chem. Front., 2015, 2, 106-109; Org. Chem. Front., 2016, 3, 496-500)。選用其中的部分衍生物作為化學探針,他們還發現了一種獨特的硫肽抗生素殺滅胞內寄生菌的雙重作用機制(Chem. Biol., 2015, 22, 1002-1007),這為未來抗感染藥物的研發給出了新的啟示。基于上述研究結果,該課題組系統性地闡釋了硫鏈絲菌素的側環結構與其優良生物活性的構效關系。
在最近的研究過程中,他們基于同樣的策略使用不同的合成前體對相同的突變菌株進行化學喂養,卻發現了與預期產物不一致的硫肽衍生物。在使用前體7-F-QA喂養突變株△tsrT時,他們發現了一個側環結構不完整的氟代TSR衍生物,其中喹萘啶酸(QA)結構單元沒有發生相應的氧化后修飾。以此種具備二酮結構特征的TSR流產產物(shunt product)作為預期,他們研究了TSR生物合成途徑與分子骨架氧化后修飾相關的基因功能,通過基因敲除/回補、化學喂養、體外酶學測活等手段,最終確定了P450蛋白TsrP負責了TSR側環形成過程中QA結構單元的環氧化反應(ACS Chem. Biol., 2016, 11, 2673-2678)。但是至此,由于沒有獲得側環關閉過程中的關鍵中間體,關于硫鏈絲菌素側環形成的核心酶學機制還無法得到闡明。
而在本研究中,他們繼續沿用“前體導向突變生物合成”的策略,通過優化6-F-QA作為前體喂養突變株△tsrT后的發酵時間,他們成功分離、鑒定了一個側環尚未關閉但QA基團已經發生環氧化的關鍵氟代中間體。正是由于氟原子的引入,降低了催化側環形成的關鍵蛋白的酶活,從而導致了這樣一個中間體的短暫積累;而繼續延長發酵時間,該中間體會被轉化為最終成熟的6’-fluoro-TSR分子。該中間體的分離和鑒定為TSR側環生物合成途徑中的酶學機制研究奠定了重要基礎。該課題組成員通過生物信息學分析,鎖定了TSR生物合成基因簇中一個功能尚未得到歸屬的基因tsrI,其編碼的蛋白TsrI隸屬于α/β水解酶超家族。綜合使用基因敲除/回補、化學半合成模擬底物制備、體外酶學測活、化學喂養等手段,他們證實了TsrI是硫鏈絲菌素側環生物合成過程中的關鍵蛋白,該蛋白同時負責了先導肽的切除和TSR側環關閉過程的大環化反應;另外,通過序列比對、同源建模和氨基酸點突變研究,他們還在TsrI中確定了α/β水解酶超家族高度保守的“催化三聯體”氨基酸殘基(Asp-His-Ser)。雖然目前已有十余種α/β水解酶超家族蛋白的不同活性相繼得到了報道,但是同時兼具蛋白內切酶活性和催化游離氨基進行環氧開環活性的“雙功能”α/β水解酶在此前的研究中卻從未被發現。該研究中關于TsrI功能的闡明,不但解決了長期以來困擾人們的雙環硫肽抗生素側環如何關閉的問題,更拓展了人們對于α/β水解酶這一超家族蛋白生化功能的進一步認識和理解,同時為基于合成生物學策略改造雙大環硫肽類抗生素分子結構的研究奠定了基礎。
上述成果均主要由劉文課題組的在讀博士生鄭慶飛、副研究員王守鋒等完成,并獲得了國家自然科學基金委、科技部、上海市科委和中科院等相關項目的大力資助。
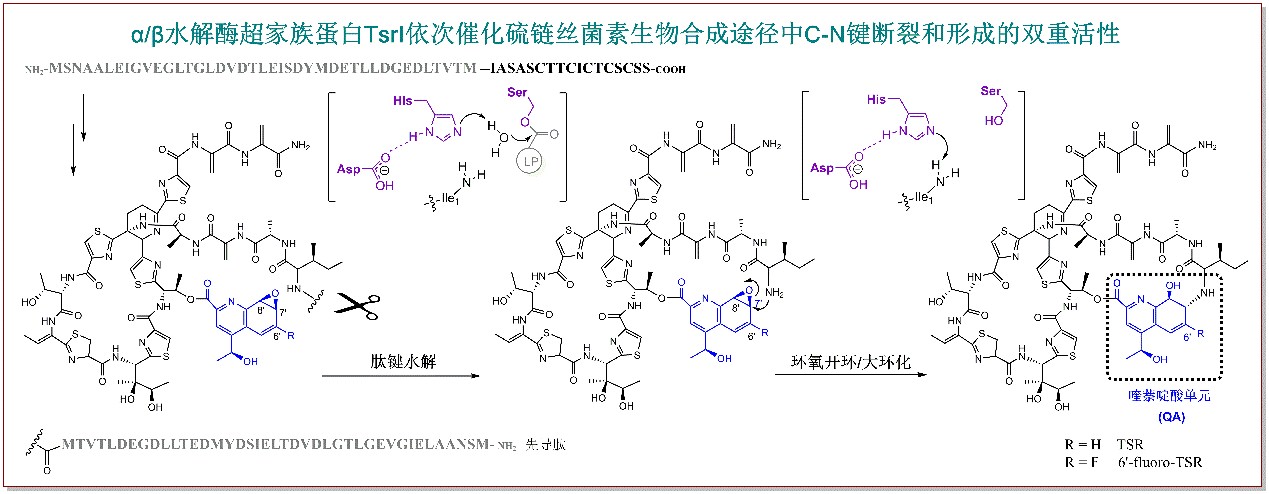
α/β水解酶超家族蛋白TsrI依次催化硫鏈絲菌素生物合成途徑中C-N鍵斷裂和形成的雙重活性
標簽:
相關資訊
2、如涉及作品內容、版權和其它問題,請在30日內與本網聯系,我們將在第一時間作出適當處理!有關作品版權事宜請聯系:+86-571-88970062